
本研究成功开发了两种新型无重金属的近红外光敏剂BDP-Q1和BDP-Q2,它们利用供体激发的光诱导电子转移(d-PeT)驱动的自旋-轨道电荷转移间系交叉(SOCT-ISC)机制,在低极性环境中产生单线态氧,而在水性环境中形成纳米聚集体产生超氧阴离子和羟基自由基。这些光敏剂展现出高效的光细胞毒性,能够在亚微摩尔水平上抑制癌细胞增殖,且通过开发肿瘤靶向光敏剂Glu-BDP-Q2,实现了对癌细胞的特异性杀伤,减少了对正常组织的光损伤,为光动力疗法在缺氧肿瘤治疗中的应用提供了新策略。
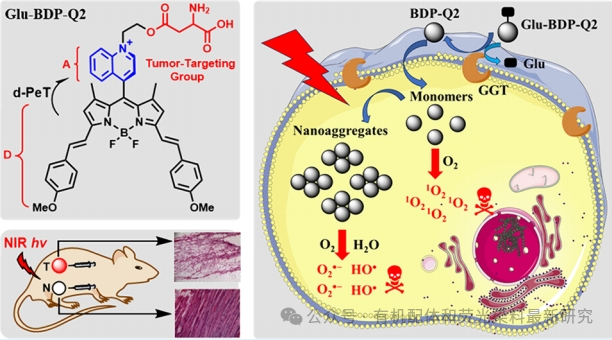
文章摘要提到,自旋-轨道电荷转移间系交叉(SOCT-ISC)光物理过程在构建无重金属光敏剂(PSs)用于肿瘤光动力疗法(PDT)方面展现出巨大潜力。然而,迄今为止报道的几乎所有这类PSs的SOCT-ISC都是由受体激发的光诱导电子转移(a-PeT)驱动的。在这项工作中,作者首次利用供体激发的光诱导电子转移(d-PeT)驱动的SOCT-ISC机制来构建无重金属PSs,用于肿瘤的PDT。通过将电子不足的N-烷基喹啉鎓单元(作为电子受体)直接引入到近红外(NIR)二苯并吲哚(Bodipy)荧光团(作为电子给体)的meso位置来实现。
在低极性环境中,PSs以单体形式存在,并通过d-PeT驱动的SOCT-ISC的三重激发态的种群来促进单线态氧(1O2)的产生(II型机制),而在水性环境中,它们以纳米聚集体形式存在,并通过d-PeT驱动的分散电荷分离态的形成来诱导超氧阴离子(O2−•)和羟基自由基(HO•)的生成(I型机制)。这些PSs能够迅速被癌细胞内化,并在近红外光照射下同时诱导细胞内1O2、O2−•和HO•的产生,赋予PSs在正常氧合或缺氧条件下都具有卓越的光细胞毒性,IC50值达到亚微摩尔水平。
基于PSs平台,开发了一种肿瘤靶向PS,并在体外和体内验证了其在不损伤正常细胞/组织的情况下杀死癌细胞和消融肿瘤的能力。该研究通过引入d-PeT概念,扩展了PSs的设计范围,因此对于实现肿瘤PDT领域的新型PSs具有很高的价值。
1、研究背景
光动力疗法(PDT)是一种利用光敏剂(PS)、光和分子氧(O2)通过产生活性氧(ROS)来诱导光毒性的治疗方法,适用于多种疾病,特别是癌症。与传统的癌症治疗手段相比,PDT具有高时空精度、非侵入性、可重复治疗、低药物抗性和激活免疫系统等优点。光敏剂作为PDT的关键组成部分,在PDT过程中发挥中心作用。本文中,作者提出了一种新型的无重金属光敏剂,通过供体激发的光诱导电子转移(d-PeT)驱动自旋-轨道电荷转移间系交叉(SOCT-ISC)机制,用于肿瘤的PDT。
2、研究要点:
(1)无重金属光敏剂的开发:研究团队开发了两种新型无重金属的光敏剂(BDP-Q1和BDP-Q2),这些光敏剂基于供体激发的光诱导电子转移(d-PeT)驱动的自旋-轨道电荷转移间系交叉(SOCT-ISC)机制。
(2)双模式光疗机制:这些光敏剂能够在不同的环境条件下,通过I型和II型机制产生不同的活性氧(ROS)。在低极性环境中,它们以单体形式存在,通过d-PeT驱动的SOCT-ISC产生单线态氧(1O2)。在水性环境中,它们形成纳米聚集体,通过d-PeT驱动形成分散电荷分离态,从而产生超氧阴离子(O2−•)和羟基自由基(HO•)。
(3)光敏剂的快速细胞内化:BDP-Q1和BDP-Q2能够迅速被癌细胞内化,并在近红外光照射下诱导细胞内产生1O2、O2−•和HO•。
(4)卓越的光细胞毒性:这些光敏剂展现出卓越的光细胞毒性,具有亚微摩尔级别的IC50值,无论是在正常氧合还是缺氧条件下。
(5)肿瘤靶向光敏剂的开发:研究中还开发了一种肿瘤靶向光敏剂Glu-BDP-Q2,通过γ-谷氨酰转肽酶(GGT)催化释放活性光敏剂BDP-Q2,实现了对癌细胞的特异性杀伤。
(6)体外和体内研究的验证:通过体外实验和体内动物模型,验证了这些光敏剂在不损伤正常细胞或组织的情况下,杀死癌细胞和消融肿瘤的能力。
(7)光敏剂设计范围的扩展:这项研究通过引入d-PeT概念,扩展了光敏剂的设计范围,为实现肿瘤PDT领域的新型光敏剂提供了新的价值。
Scheme1:Schematic Representations of the Proposed Mechanisms
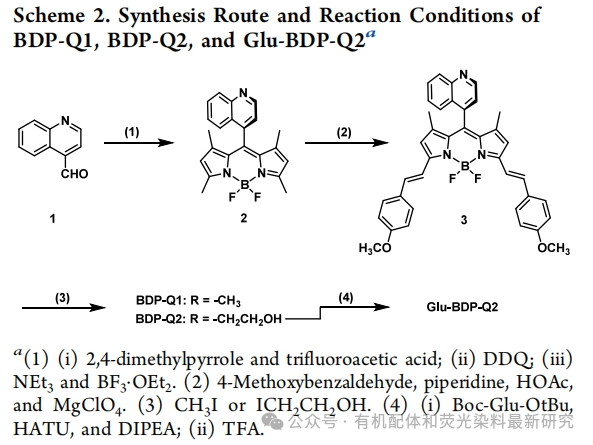
3、实验部分
本部分详细描述了实验所用的材料、仪器和方法。包括化合物的合成、光物理性质的测定、光热转换效率的计算、单线态氧和超氧阴离子自由基的检测等。此外,还进行了细胞培养和体外光毒性研究,以及在小鼠模型上的体内成像和光动力疗效评估。
相关研究图文:
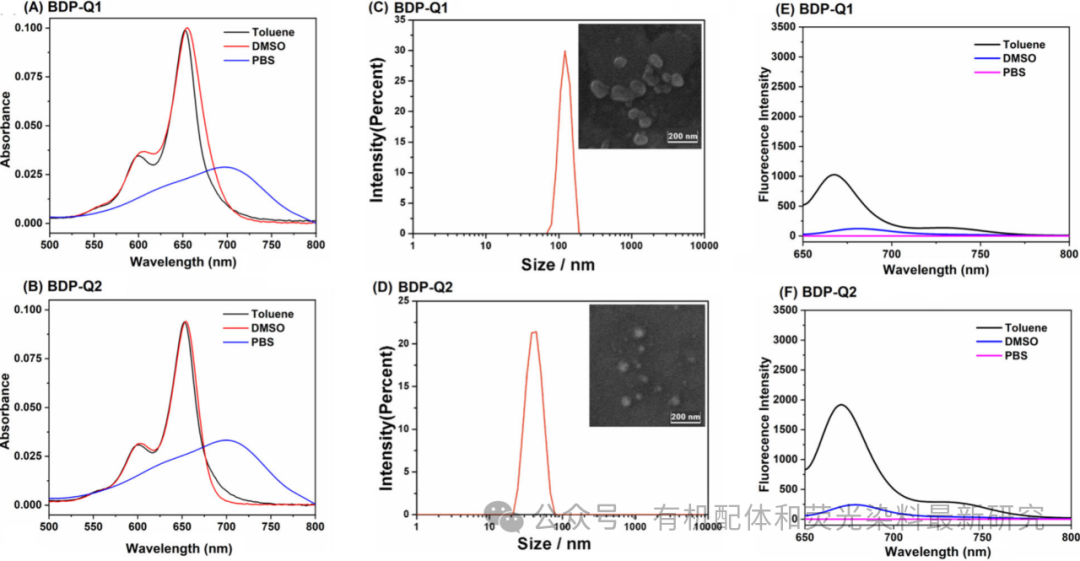
图 1. (A 和 B) BDP-Q1/BDP-Q2(均为 1 μM)在甲苯、DMSO 和 PBS(10 mM,pH = 7.4)中的吸收光谱。(C 和 D) DLS 和 TEM(插图)表征水中的 BDP-Q1/BDP-Q2(均为 1 μM)纳米聚集体。(E 和 F) BDP-Q1/BDP-Q2(均为 1 μM)在甲苯、DMSO 和 PBS(10 mM,pH = 7.4)中的荧光光谱(λex = 640 nm)。
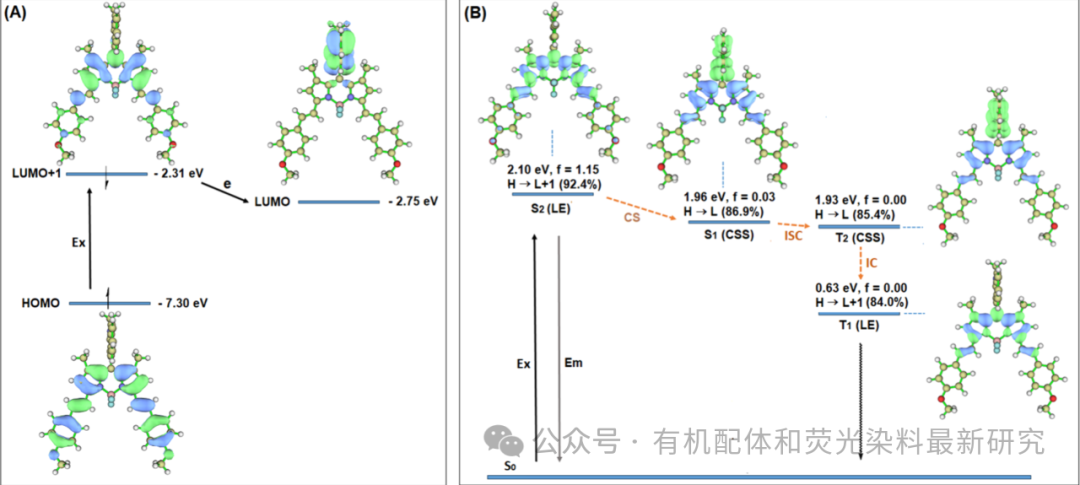
图 2. (A) 通过 DFT 计算的 BDP-Q1 前线分子轨道和 (B) 通过 TDDFT 计算的 BDP-Q1 的 S1、S2、T1 和 T2 态能级,两者均在 Gaussian 09 的 wb97xd/6-31g* 水平上,应用了甲苯的可极化连续模型溶剂化。f 值表示振荡器强度。没有考虑自旋轨道耦合效应;因此,T2 和 T1 的 f 值为零。(B) 中的蓝色和绿色表示空穴和电子分布。
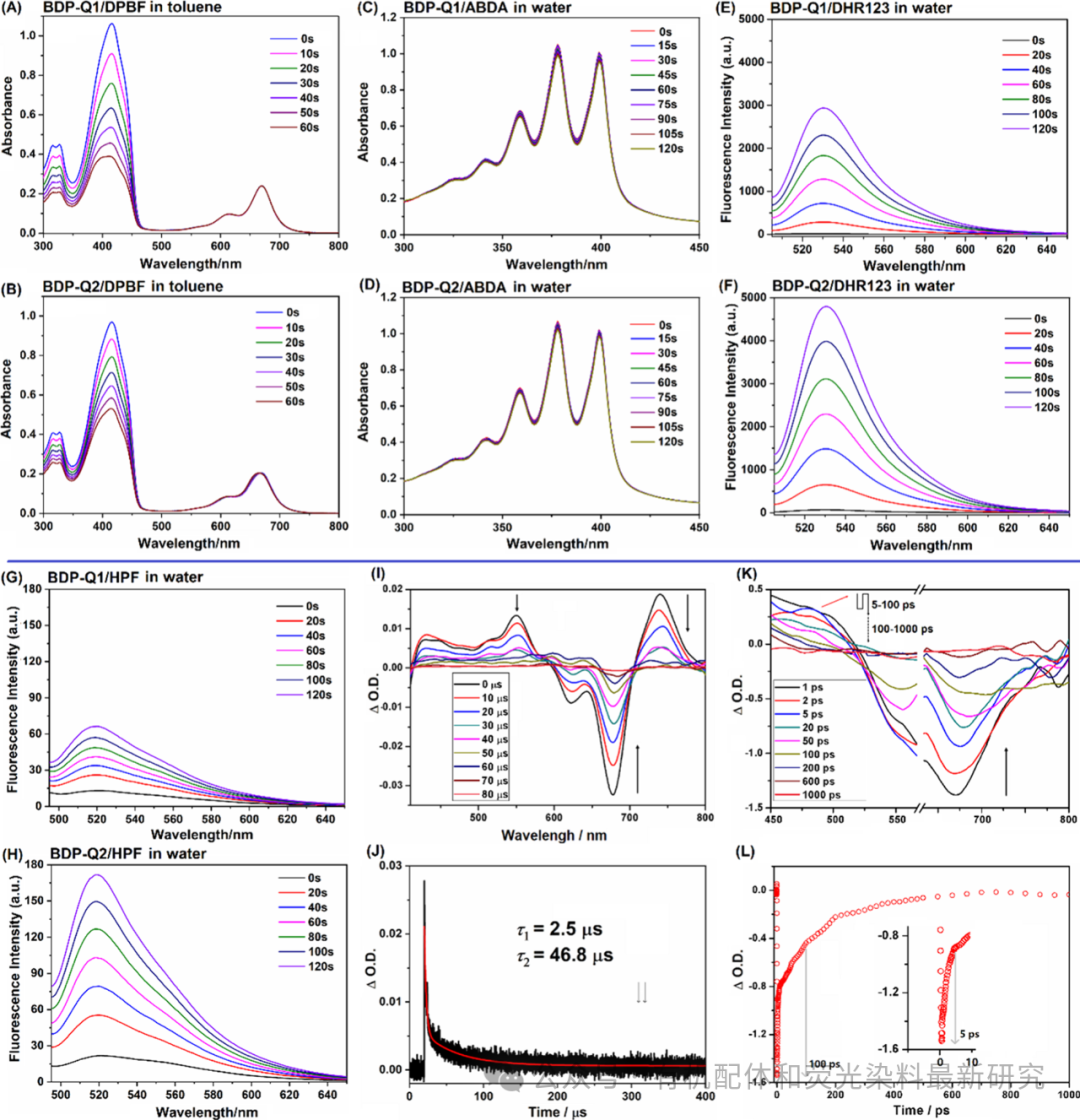
图 3. (A和B) 在连续660纳米LED光(5毫瓦/平方厘米)照射下,BDP-Q1/DPBF和BDP-Q2/DPBF甲苯溶液的吸收光谱变化。光敏剂(PS)的浓度为3微摩尔。(C和D) 在连续660纳米LED光(5毫瓦/平方厘米)照射下,BDP-Q1/ABDA和BDP-Q2/ABDA水溶液的吸收光谱变化。光敏剂(PS)的浓度为3微摩尔。(E和F) 在连续660纳米LED光(5毫瓦/平方厘米)照射下,BDP-Q1/DHR123和BDP-Q2/DHR123水溶液的荧光光谱变化。DHR123和光敏剂(PS)的浓度分别为20和10微摩尔。(G和H) 在连续660纳米LED光(30毫瓦/平方厘米)照射下,BDP-Q1/HPF和BDP-Q2/HPF水溶液的荧光光谱变化。HPF和光敏剂(PS)的浓度分别为20和10微摩尔。对于DHR123,激发波长为495纳米;对于HPF,激发波长为485纳米。(I和J) 在去氧甲苯中(激发波长="""530纳米),BDP-Q1的纳秒瞬态吸收光谱及其在550纳米处的相应衰减动力学。(K和L)""" 在水中(激发波长="""600纳米),BDP-Q1的皮秒瞬态吸收光谱及其在660纳米处的相应衰减动力学。为了排除假阳性,还在无光敏剂(PS)的条件下,对上述活性氧(ROS)探针在660纳米LED光照射下的吸光度或荧光发射变化进行了检测(见图S10)。
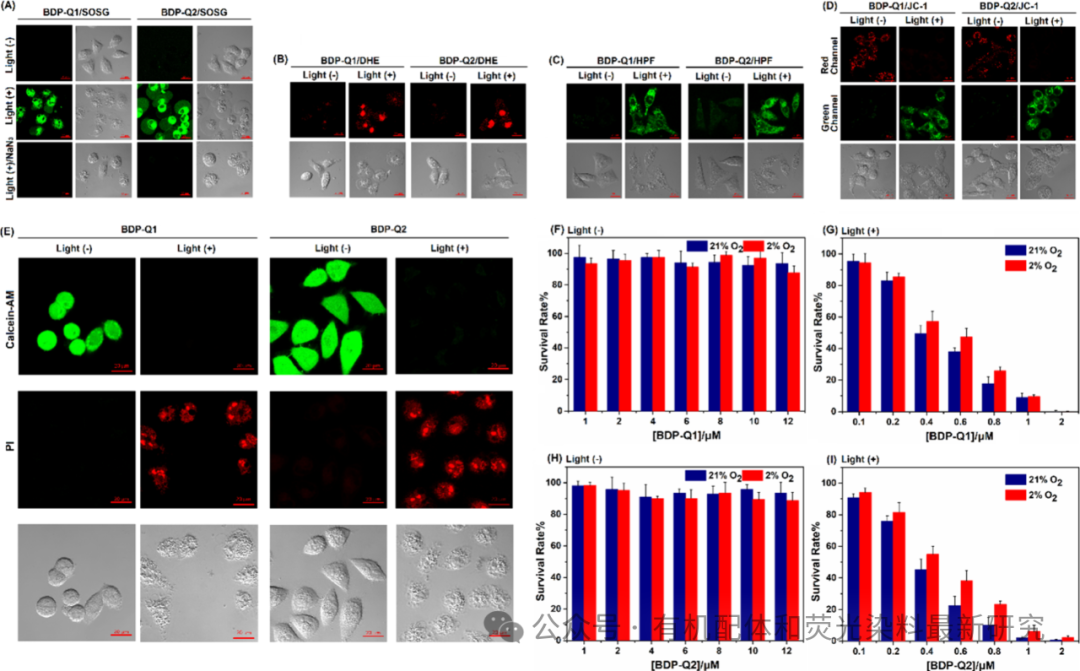
图 4. (A) A549细胞与BDP-Q1 (1.0 μM)/SOSG (10.0 μM)或BDP-Q2 (1.0 μM)/SOSG (10.0 μM)共染的共聚焦荧光图像,在NaN3 (50 μM)存在和不存在的情况下,以及在连续660 nm LED光(20 mW/cm²,20分钟)照射和不照射条件下。(B) A549细胞与BDP-Q1 (1.0 μM)/DHE (10.0 μM)或BDP-Q2 (1.0 μM)/DHE (10.0 μM)共染的共聚焦荧光图像,在连续660 nm LED光(20 mW/cm²,20分钟)照射和不照射条件下。(C) A549细胞与BDP-Q1 (1.0 μM)/HPF (5.0 μM)或BDP-Q2 (1.0 μM)/HPF (5.0 μM)共染的共聚焦荧光图像,在连续660 nm LED光(20 mW/cm²,20分钟)照射和不照射条件下。(D) A549细胞与BDP-Q1 (1.0 μM)/JC-1 (10.0 μM)或BDP-Q2 (1.0 μM)/JC-1 (10.0 μM)共染的共聚焦荧光图像,在连续660 nm LED光(20 mW/cm²,20分钟)照射和不照射条件下。(E) A549细胞与BDP-Q1 (1.0 μM)(或BDP-Q2)、calcein AM (5.0 μM)或PI (1.0 μM)共染的共聚焦荧光图像,在连续660 nm LED光(20 mW/cm²,20分钟)照射和不照射条件下。(F和G) 分别在正常氧气条件(21% O2)和缺氧条件(2% O2)下,BDP-Q1负载的A549细胞在黑暗中和在660 nm LED光(20 mW/cm²,20分钟)照射下的剂量依赖性活性。同样条件下,BDP-Q2负载的A549细胞的剂量依赖性活性。MTT实验在24小时孵育后进行。对于SOSG,收集的发射波长范围为493至565纳米(激发波长λex = 488纳米);对于DHE,收集的发射波长范围为570至620纳米(激发波长λex = 514纳米);对于HPF,收集的发射波长范围为493至550纳米(激发波长λex = 488纳米);对于JC-1,红色通道收集的发射波长范围为573至640纳米(激发波长λex = 561纳米),绿色通道收集的发射波长范围为493至550纳米(激发波长λex = 488纳米);对于calcein AM,收集的发射波长范围为493至550纳米(激发波长λex = 488纳米);对于PI,收集的发射波长范围为600至700纳米(激发波长λex = 561纳米)。比例尺:20微米。所有这些细胞实验都是在细胞培养基DMEM中进行的。
4、结果和讨论
作者首先合成了目标化合物,并通过各种光谱技术表征了它们的性质。在不同溶剂中,BDP-Q1和BDP-Q2展现出不同的光物理行为,包括吸收光谱、荧光光谱和光热转换效率的变化。在水性环境中,这些化合物形成纳米聚集体,通过d-PeT驱动的机制产生超氧阴离子和羟基自由基。体外实验表明,这些光敏剂在近红外光照射下对癌细胞具有显著的光细胞毒性。此外,还开发了一种肿瘤靶向光敏剂Glu-BDP-Q2,并在体外和体内验证了其光动力疗效。
5、结论
本研究成功构建了两种无重金属的近红外光敏剂BDP-Q1和BDP-Q2,它们通过d-PeT驱动的SOCT-ISC机制在低极性环境中产生单线态氧,在水性环境中形成纳米聚集体产生超氧阴离子和羟基自由基。这些光敏剂在体外和体内均显示出优异的光细胞毒性,且Glu-BDP-Q2作为一种肿瘤靶向光敏剂,能有效减少对正常组织的光损伤。这项工作不仅扩展了基于SOCT-ISC的光敏剂的设计范围,还为提高这类光敏剂在极性水中产生活性氧的能力提供了有效方法。