
1.简介
三阴性乳腺癌 (TNBC)被归类为免疫学上的“冷”类型,具有免疫细胞浸润低和免疫抑制微环境的特征,这使得临床治疗更加困难。而TNBC 对铁死亡具有高度敏感性,这与铁死亡基因特征的独特表达模式有关。此外,铁死亡已被证明可以限制冷肿瘤中免疫抑制细胞的功能,例如相关巨噬细胞和调节性 T 细胞,将免疫抑制微环境转化为富含抗肿瘤免疫细胞的炎症微环境,并增强铁死亡扩增免疫疗法的抗肿瘤作用。因此,在 TNBC 细胞中触发铁死亡可能是一种潜在的治疗方法,具有直接杀死肿瘤细胞和重新构建肿瘤微环境的双重作用。
基于此,在本研究中,作者开发了一种具有肿瘤靶向和双刺激响应性释放特性的多功能纳米脂质体(Lipo MT-SNAP),以研究 ONOO− 突发生成对肿瘤细胞铁死亡的影响。通过常规薄膜水合法将O2−、S-亚硝基-N-乙酰 DL-青霉胺 (SNAP)、I 型光敏剂 (命名为 MT) 和两亲性DSPE-SS-PEG-cRGD 封装到脂质体中。SNAP 作为 GSH 反应性的 NO 供体,可以在富含 GSH 的肿瘤细胞中特异性释放 NO。MT是一种光敏剂,具有聚集诱导的红色发射和优越的 ·O2−光照射下的生成能力。嵌入脂质体脂质双层中的 DSPE-SS-PEG-cRGD 可以靶向肿瘤细胞,。进入肿瘤细胞后,产生的 ONOO− 可突破 GPX4 因 GSH 消耗而减弱的铁死亡系统。此外,TNBC 细胞释放钙网蛋白 (CRT) 和高迁移率族 1 蛋白 (HMGB1),并激活强大的免疫原性细胞死亡 (ICD),从而促进树突状细胞的成熟并改善 T 淋巴细胞浸润。
【Lipo-MT-SNAP引发 TNBC 细胞铁死亡并激活全身免疫的示意图】
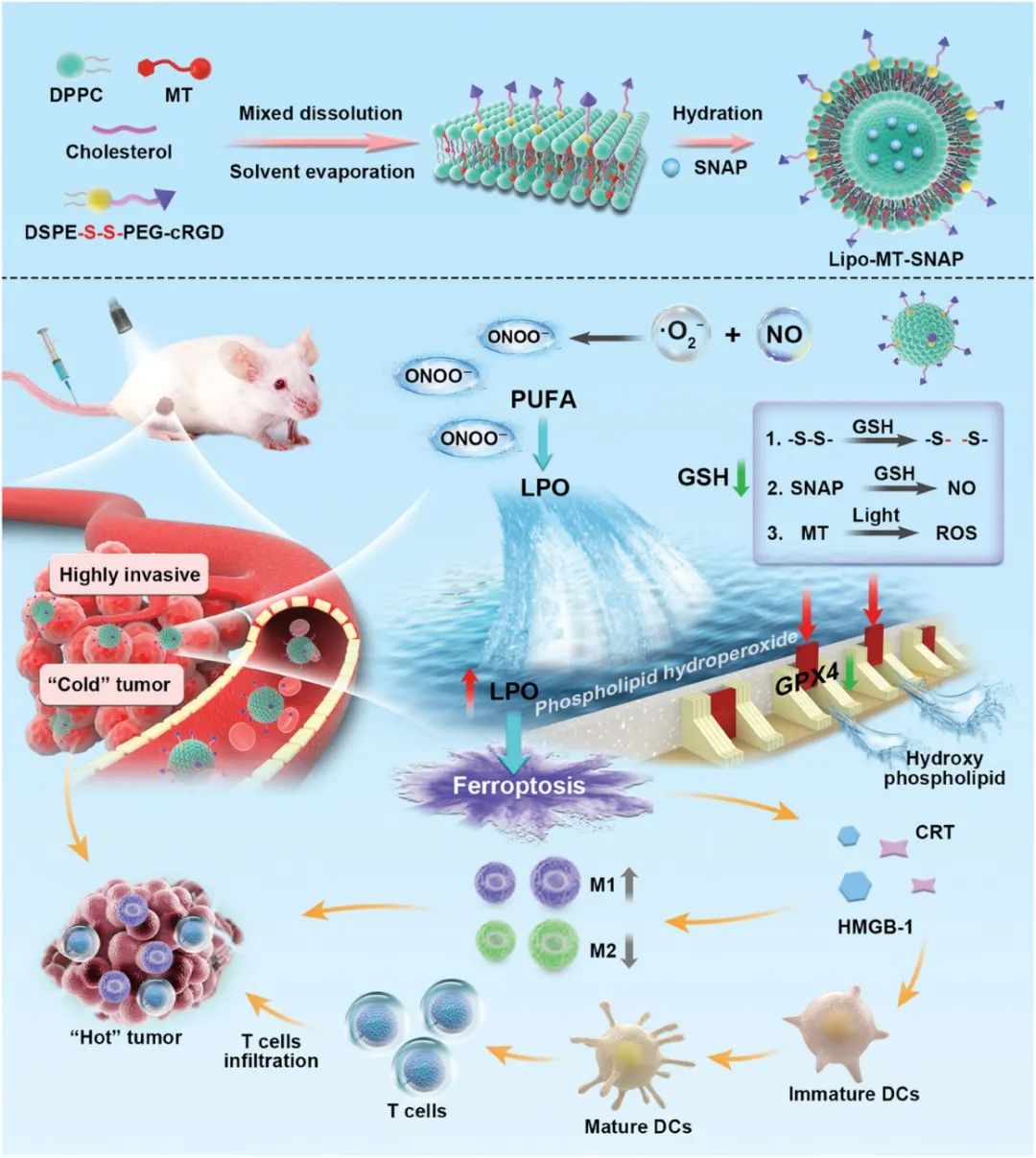
方案1. Lipo-MT-SNAP引发 TNBC 细胞铁死亡并激活全身免疫的示意图。
【脂质体的形成及性质】
脂质体Lipo-MT-SNAP的结构模型及各组分的化学结构如图 1a所示。如图 1b所示,Lipo-MT-SNAP 的吸收光谱中观察到 340 nm 处的吸收峰属于 SNAP,480 nm 处的吸收峰属于 MT,而在 Lipo-MT 和 Lipo-SNAP 的吸收光谱中均未观察到此吸收峰,证实了包裹的 MT 和 SNAP 的存在。此外,由于 AIE 特性,在 Lipo-MT 和 Lipo-MT-SNAP 的荧光光谱中观察到 MT 的强荧光(图 1c)。动态光散射测量表明,与其他脂质体相比,Lipo-MT-SNAP 的粒径(约 175 nm)最大(图 1d)。脂质体溶液照片显示含有 MT 的溶液呈现出特定的红色。透射电子显微镜 (TEM) 图像显示 Lipo-MT-SNAP 呈均匀的球形形色色(图 1e)。在确定了Lipo-MT-SNAP的结构后,进一步研究了组装脂质体在光催化下生成ONOO −的能力。Lipo-MT-SNAP 在光照下具有与 MT 类似的·O2−生成能力(图1f),包括总 ROS 的生成。然后,使用 Griess 试剂检测 Lipo-MT-SNAP 中 NO 的生成。如图 1g所示,未经 GSH 处理的脂质体中检测到少量 NO 生成,而有 GSH 存在时则释放出大量 NO,表明 NO 生成的可控性和 GSH 响应性从Lipo-MT-SNAP中制备NO。以L-酪氨酸为探针检测到ONOO −的生成。如图 1h所示,在 GSH 和光同时处理 Lipo-MT-SNAP 溶液时,L-酪氨酸二聚化(Dityr)产生了显著的荧光(在 406 nm),表明有大量 ONOO −生成。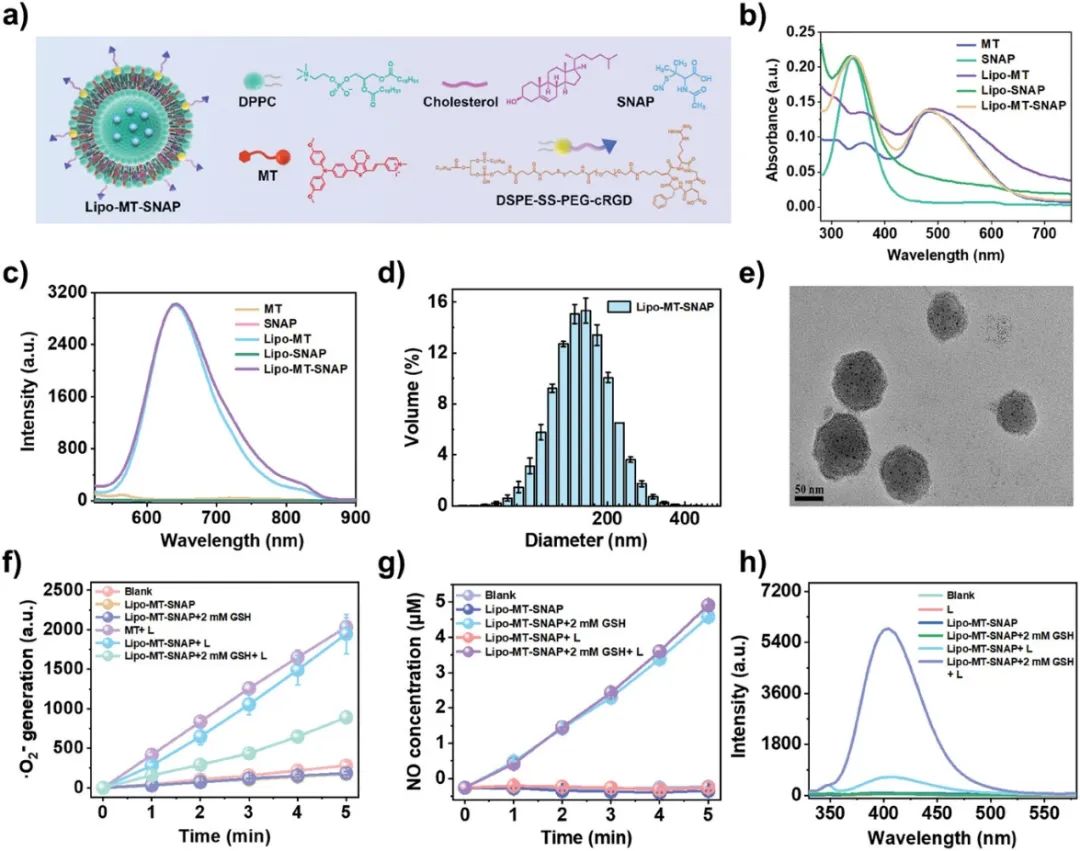
图1. 脂质体的形成及性质。
【细胞摄取和体外细胞毒性分析】
以4T1细胞和L929细胞分别作为肿瘤细胞和正常细胞的代表,进行细胞摄取研究(图 2a)。37 ℃下与脂质体孵育10 min后,在4T1细胞中观察到Lipo-MT-SNAP中插入的MT聚集诱导的红色荧光,但在L929细胞中未观察到,表明Lipo-MT-SNAP被肿瘤细胞特异性摄取。然而,用未经cRGD处理的脂质体(表示为Lipo(0)-MT-SNAP)处理后的两种细胞中均未观察到荧光。为了进一步证明4T1 和 MDA-MB-231 细胞中ONOO −的生成源于 NO 与·O2−的反应,首先以 DAF-FM DA 和 DHE 分别作为相应的荧光探针研究了细胞内 NO 和·O2−的生成。如图 2b所示,在光照下,在经含有 MT 的脂质体(Lipo-MT 和 Lipo-MT-SNAP)处理的 4T1 细胞和 MDA-MB-231 细胞中观察到·O2−探针的亮红色荧光,表明大量产生·O2−。辐照后的 Lipo-MT-SNAP 可以在 4T1 细胞和 MDA-MB-231 细胞中生成 ONOO −,从而引发 O56 的明亮绿色荧光(图 2b)。因此,通过合理设计响应性脂质体可以实现程序化和可控的 ONOO −释放。具有有效 ONOO −生成和肿瘤靶向能力的 Lipo-MT-SNAP有利于肿瘤细胞的活性调控。经典 MTT (甲基噻唑基四唑) 实验显示在光照下 Lipo-MT-SNAP 对 4T1 和 MDA-MB-231 细胞的生长抑制效果最强, 尽管在相同条件下 Lipo-MT 和 Lipo-MT-SNAP 的抑制效果不同 (图 2c)。这说明NO 与·O2−反应生成有效 ONOO −比 ROS 或 NO 单独作用对细胞的损伤更严重 (图 2d)。没有光照时, 由于没有 ROS, Lipo-MT-SNAP 的杀伤效果明显下降。此外, 使用 Calcein AM 和 PI 染料进行细胞染色的结果与 MTT 的结果一致, 进一步表明 ONOO −对肿瘤细胞的损伤最强 (图 2e)。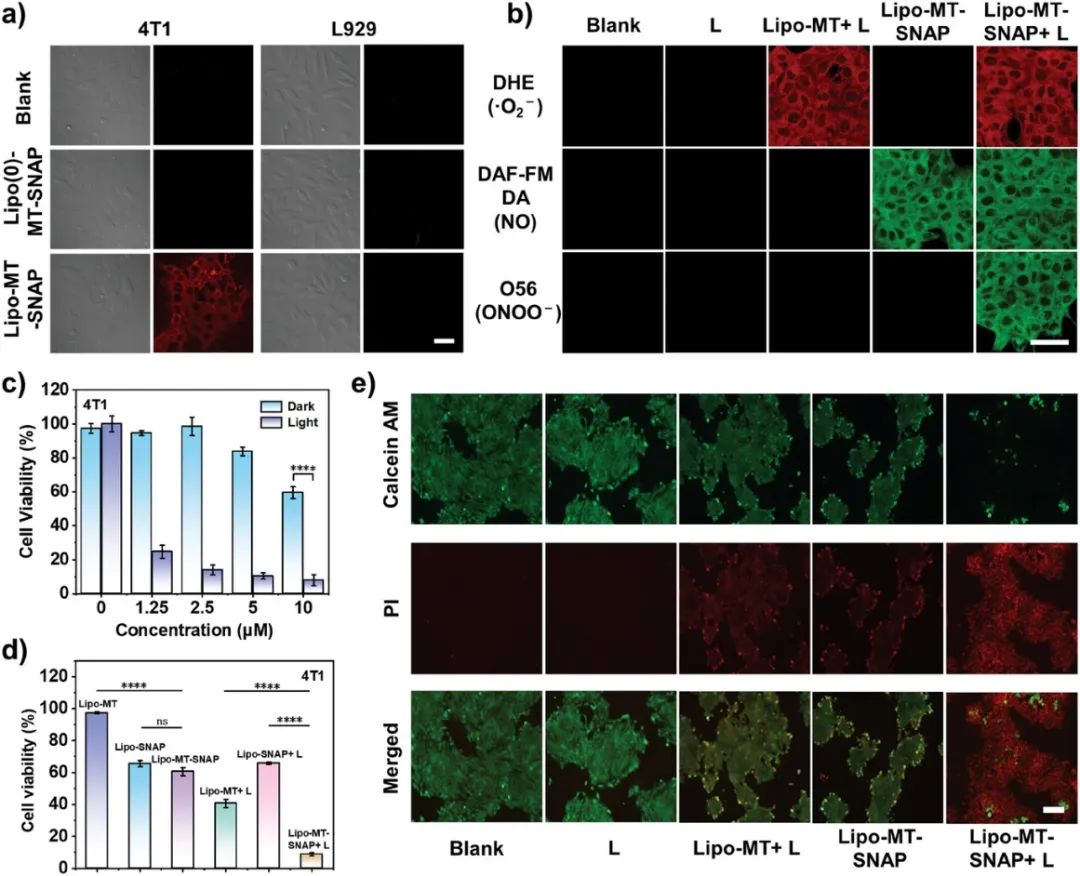
图2. 细胞摄取和体外细胞毒性分析。
【Lipo-MT-SNAP诱导的铁死亡及免疫】
如图 3a所示,ONOO−可以直接氧化细胞膜上的多不饱和脂肪酸生成LPO。细胞内 GSH 的消耗和 ROS 的产生导致GPX4 合成受阻,也会导致 LPO 的增强。细胞内 LPO 的这种积累随后导致细胞铁死亡。如图 3b所示,通过 Western blot 检测 GPX4 和 HO-1。结果显示,与其他组相比,Lipo-MT-SNAP+ L 组的 HO-1 表达最高。与其他组相比,Lipo-MT-SNAP+ L 组的 GPX4 表达受到很大抑制。由于铁死亡可能是由细胞中大量生成 LPO 引起的,因此 LPO 分解的重要副产物 MDA 可直接反映铁死亡的程度。如图 3c所示,处理 4T1 细胞后,Lipo-MT-SNAP+ L 组的 MDA 水平明显高于其他任何对照组。此外,还利用生物透射电子显微镜研究了脂质体诱导的4T1细胞铁死亡(图 3d)。通过 C11-BODIPY 581/591 荧光探针通过 CLSM 成像进一步评估了 LPO 的形成(图 3e)。通过特异性氧化检测到 LPO 积累并发出强烈的绿色荧光。值得注意的是,用 C11-BODIPY 581/591 染色时,与其他组相比,在 Lipo-MT-SNAP+ L 组中观察到更明显的从红色到绿色的荧光转变。这表明在 Lipo-MT-SNAP+ L 处理的细胞中强烈诱导了 LPO 积累。经Lipo-MT-SNAP+ L处理后的4T1细胞和MDA-MB-231细胞继续孵育4 h,分离细胞进行CLSM成像,取上清液用ELISA试剂盒检测。经Lipo-MT-SNAP+ L处理后的细胞在上清液中释放的HMGB1最多(图 3f),且CRT荧光强度与其他组相比最强(图 3g),提示ICD发生活跃。这些结果表明光照下的Lipo-MT-SNAP能有效原位产生ONOO −诱导肿瘤细胞铁死亡,引发剧烈的ICD。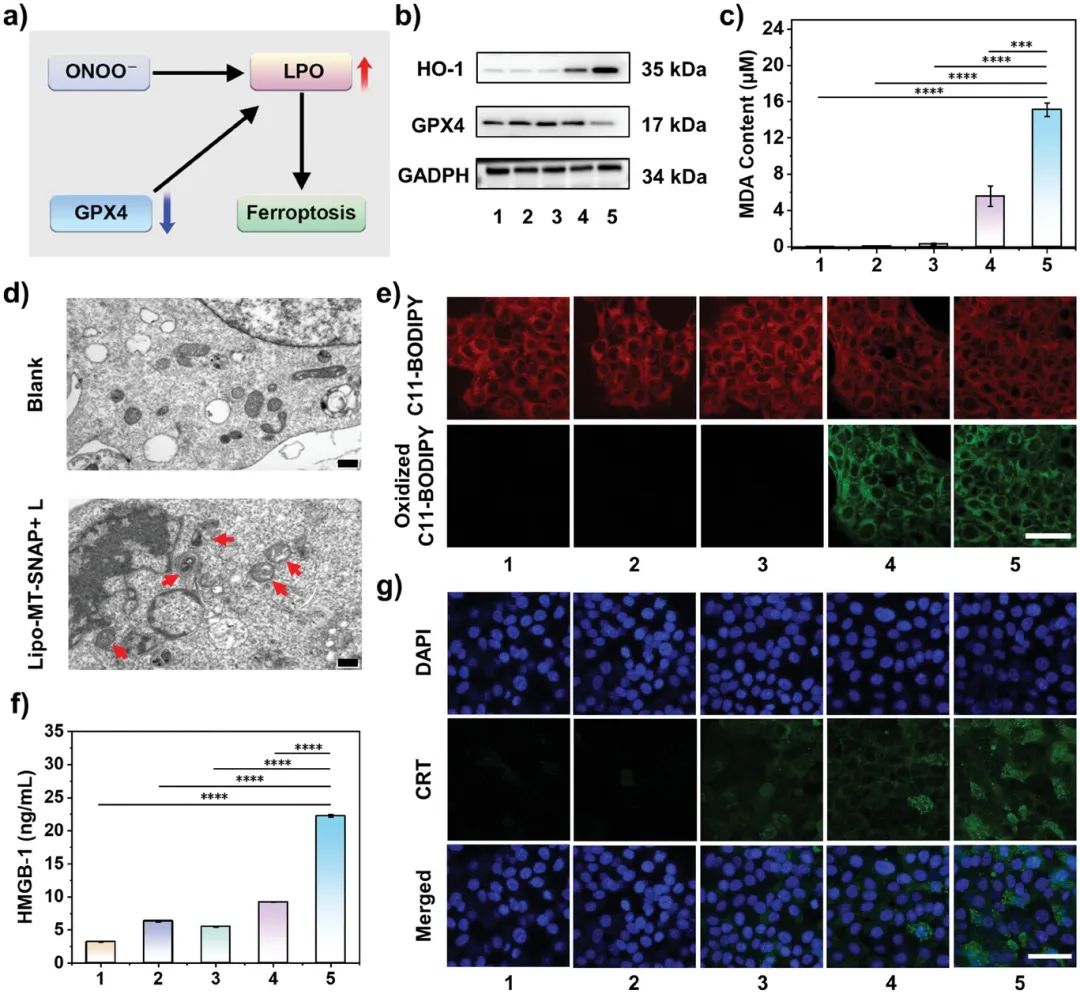
图3. Lipo-MT-SNAP诱导的铁死亡及免疫。
【体内抗肿瘤评价】
将具有近红外区荧光成像能力的ICG包裹于脂质体中,经尾静脉注射后,体内荧光成像显示靶向脂质体在肿瘤部位进行性富集(图 4a)。在4T1荷瘤小鼠异种移植模型中评估不同脂质体的抑癌效果。当肿瘤体积达100 mm 3 时,将荷瘤小鼠随机分为5组(Blank、L、Lipo-MT+L、Lipo-MT-SNAP和Lipo-MT-SNAP+L),治疗方案如图 4b所示。经过2次注射和光照后,在11天的治疗期内每2天监测一次肿瘤体积。如图 4c所示,Blank和L组肿瘤生长速度较快。Lipo-MT+ L组肿瘤生长速度慢于Lipo-MT-SNAP组,值得注意的是,Lipo-MT-SNAP+ L组肿瘤得到明显抑制。脂质体对小鼠的副作用很小,各组小鼠体重几乎没有变化(图 4d)。以上实验表明,·O 2 −和NO单独作用对肿瘤生长有一定的抑制作用,但在肿瘤部位 高效产生ONOO − ,可完全抑制肿瘤生长(图4e)。如图 4f所示,肿瘤H&E染色结果显示Lipo-MT-SNAP+ L组的肿瘤损伤最为严重。Ki67染色结果显示,Blank组和L组的Ki67阳性率最高,其次是Lipo-MT-SNAP和Lipo-MT+ L组,Ki67阳性率中等,最后是Lipo-MT-SNAP+ L组,Ki-67阳性率较低。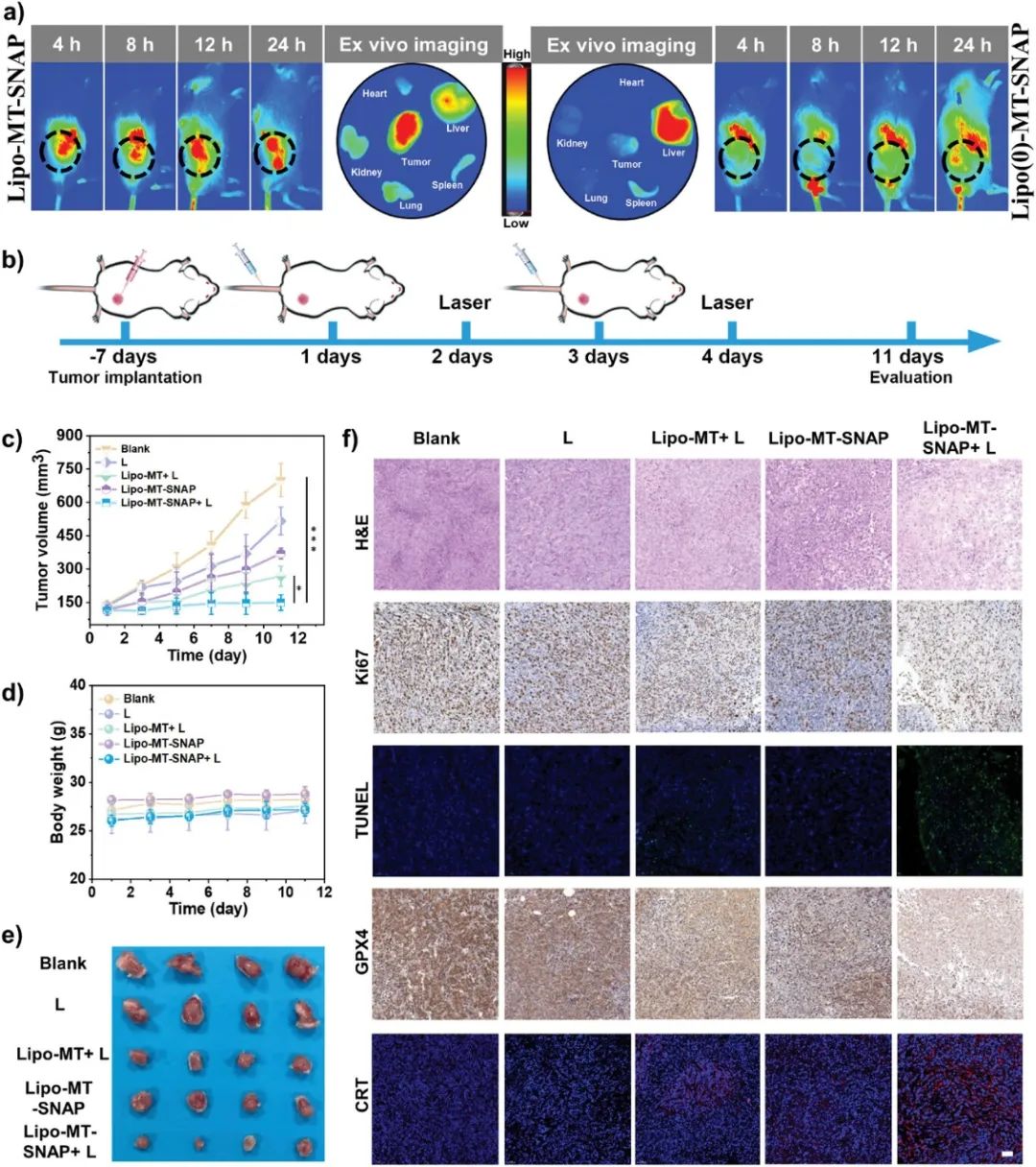
图4. 体内抗肿瘤评价。
【体内免疫评价】
为了了解ONOO −对免疫系统激活的影响,通过检查不同实验组的肿瘤组织来测量相关参数。收集小鼠肿瘤组织进行流式细胞术分析。与Blank(1.76%)、L(2.08%)、Lipo-MT+ L(9.54%)和Lipo-MT-SNAP(8.52%)组相比,Lipo-MT-SNAP+ L组DC细胞成熟百分比(25.1%)最高(图 5a,b)。结果显示,光照下Lipo-MT-SNAP产生的ONOO −能有效促进DC细胞成熟。成熟DC细胞激活的CD8 + T细胞具有很强的识别和杀伤肿瘤细胞的能力,是抗肿瘤免疫治疗中最有效的治疗剂。因此,采用流式细胞术评估CD8 + T细胞的生产效率。正如预期的那样, Lipo-MT-SNAP+ L组 CD8 + T细胞的比例显著增加(图5c,d)。结果表明肿瘤细胞可以被活化的CD8 + T细胞浸润。此外,越来越多的证据表明,M2巨噬细胞向M1巨噬细胞的极化可以逆转免疫反应微环境。如图 5e所示,流式细胞术显示,与空白组(6.87%)、L组(6.20%)、Lipo-MT+ L组(2.21%)和Lipo-MT-SNAP组(3.12%)相比,Lipo-MT-SNAP+ L组(1.90%)的M2巨噬细胞减少最多。相应地,与空白组(5.35%)、L组(6.60%)、Lipo-MT+ L组(11.7%)和Lipo-MT-SNAP组(9.53%)相比,Lipo-MT-SNAP+ L组(15.5%)中M1巨噬细胞的值最高(图 5f)。同时,M1与M2的比例也出现了最大变化(图 5g)。上述结果表明,在光照下,Lipo-MT-SNAP促进了M2巨噬细胞向M1巨噬细胞的极化。这可能是ONOO−诱导的肿瘤细胞铁死亡引起ICD的结果。具体而言,未成熟的DC细胞变得成熟,CD8 + T细胞被激活,分泌促炎因子,如IL-6、IFN-β、IFN-γ和TNF-α(图 5h-j)。体内免疫检测实验各项结果均表明,定制化的Lipo-MT-SNAP脂质体不仅能在光照射下激活和增强适应性免疫,还能通过巨噬细胞活化逆转肿瘤微环境,提高原发性免疫抗肿瘤效果。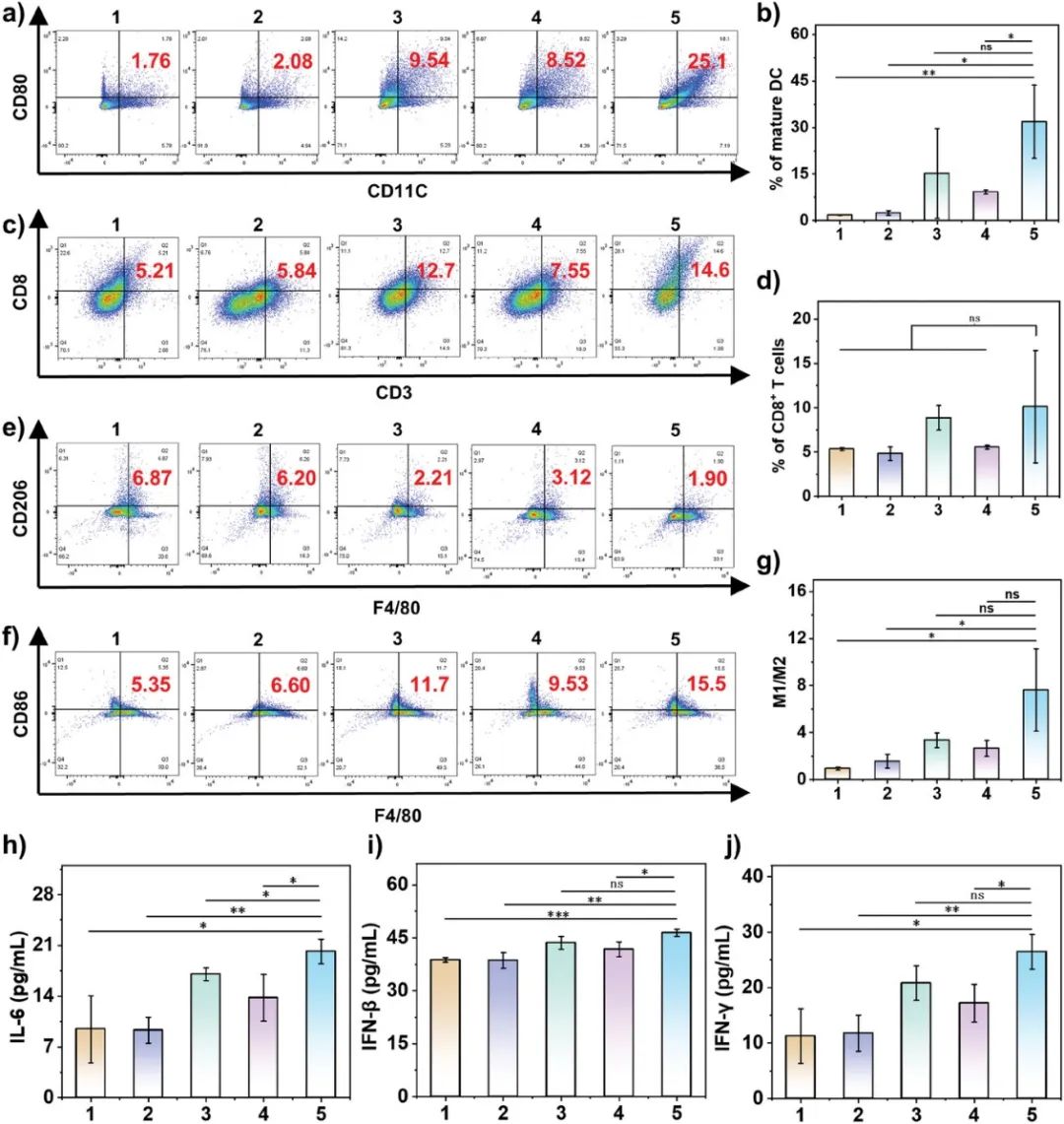
3. 总结与展望